SOLUTION D'ÉTIQUETAGE INTÉGRÉE POUR LE SECTEUR MÉDICAL
Identifiable et traçable de manière univoque : Pour garantir cela dans les dispositifs médicaux, les codes prescrits peuvent être apposés par étiquette. Nous proposons à l'industrie médicale des systèmes d'étiquetage intégrés et automatisés.
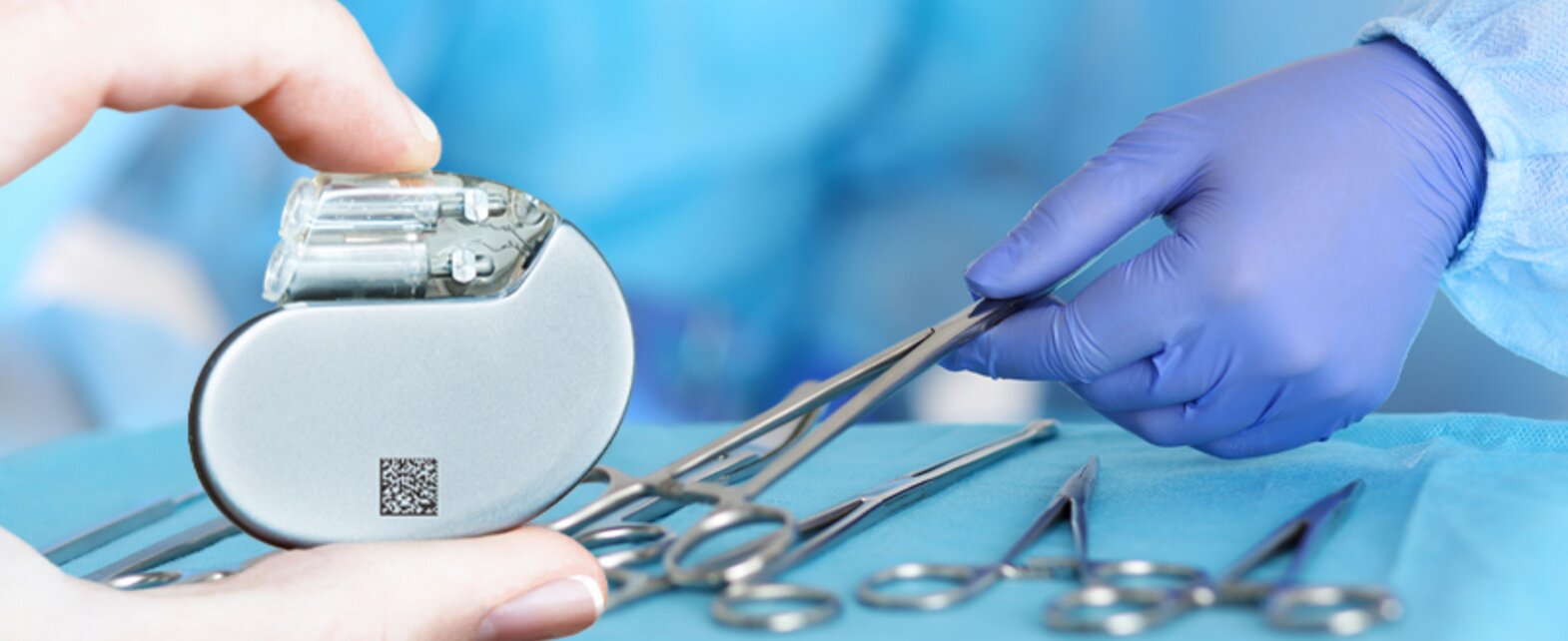
Rendre la technologie médicale identifiable
ETIQUETAGE SUR LES DISPOSITIFS MÉDICAUX ET LES EMBALLAGES
Pour une traçabilité sans faille conformément au Medical Device Regulation (MDR), deux parties du marquage UDI doivent être apposées sur chaque dispositif médical et chaque unité d'emballage : le Device Identifier (DI) et le Production Identifier (PI). Le DI est un code statique contenant une vingtaine de données sur le fabricant et le produit. Le PI contient des données variables pour la traçabilité, comme le numéro de lot, le numéro de série et la date de péremption. Le code UDI unique est attribué par l'un des quatre organismes d'attribution définis, à savoir GS1, HIBCC, ICCBBA et l'Observatoire des spécialités pharmaceutiques. Tous les dispositifs médicaux sont en outre enregistrés avec leurs données de base et le code UDI dans la base de données EUDAMED de l'UE. Il est ainsi possible de consulter à tout moment les données de base et les informations relatives au dispositif médical. L'Exigence du marquage UDI sera introduite progressivement dans l'UE pour tous les dispositifs médicaux d'ici 2027, en fonction de la classe de risque à laquelle un dispositif médical appartient.

Une Étiquette UDI pour la Sérialisation de dispositifs médicaux doit contenir deux parties du code UDI : le Device Identifier (DI) et le Production Identifier (PI). Alors que le DI contient des données statiques sur le fabricant et le produit, le PI se compose de données variables telles que le numéro de série, le numéro de lot et la date de péremption. Les deux éléments de l'UDI doivent être imprimés sur l'étiquette sous forme de codes-barres 1D ou 2D lisibles par la machine et, en outre, en textes bruts pour les utilisateurs. Le marquage UDI unique est attribué dans l'UE par l'un des quatre organismes d'attribution, à savoir GS1, HIBCC, ICCBBA et l'Observatoire des spécialités pharmaceutiques. Le code UDI et les données de base de tous les dispositifs médicaux sont enregistrés dans la base de données EUDAMED de l'UE. Les informations relatives au produit peuvent y être consultées à tout moment via le code UDI. L'Exigence du marquage UDI sera introduite progressivement dans l'UE pour tous les dispositifs médicaux d'ici 2027, en fonction de la classe de risque à laquelle le dispositif médical appartient.
A quoi faut-il faire attention pour les solutions d'étiquetage ?
- Exigences légales selon la directive MDR 2017/745 et IVDR 2017/746
- Sérialisation sans erreur
- Lisibilité par la machine des codes-barres 1D et des codes matriciels 2D
- Applicabilité rapide et économique
- Bonne adhésion, lisibilité permanente Être bien lisible
- Souvent beaucoup d'informations sur une petite surface

Les solutions d'étiquetage industrielles sont utilisées dans toute la technique médicale. Les étiquettes sont alors appliquées sur les produits médicaux eux-mêmes, mais aussi sur les emballages secondaires à tous les niveaux de conditionnement. Elles contribuent à une traçabilité sans faille et à la protection des patients dans le secteur de la technique médicale.
Exemples d'application de nos solutions d'étiquetage
- Marquage à l'encre du matériel d'emballage
- Etiqueteuses intégrées dans les lignes de production pour les emballages secondaires










Toute personne souhaitant mettre sur le marché des produits médico-techniques dans l'UE doit respecter le règlement MDR 2017/745 sur les dispositifs médicaux. Elle réglemente entre autres le marquage univoque du produit par code et textes bruts sur les dispositifs médicaux et leurs packagings par Unique Device Identification (UDI).
L'ordonnance sur les dispositifs médicaux répartit les produits en trois classes de risque. Les délais de mise en œuvre pour le marquage UDI se basent sur celles-ci. Les implants et les appareils médico-techniques des classes de risque III (risque élevé), les appareils des classes II a (risque moyen) et II b (risque élevé) doivent être marqués depuis mai 2021 ou mai 2023. Pour les autres dispositifs médicaux des classes II et I (faible risque), l'obligation d'étiquetage s'appliquera à partir de mai 2025 ou mai 2027.

